“Chemie kan een goede en een slechte zaak zijn. Chemie is goed als je er de liefde mee bedrijft. Chemie is slecht als je er crack mee maakt." - Adam Sandler
Scheikunde is een vak dat kan worden gevolgd tijdens de middelbare school of aan een universiteit als onderdeel van het vervolgonderwijs.
Sommigen hebben ervoor gekozen om meer over scheikunde te leren omdat ze de basisconcepten leuk vonden en hun kennis over het onderwerp wilden uitbreiden. Terwijl anderen dit onderwerp gedurende de laatste jaren van de middelbare school moesten bestuderen.
Eerlijk gezegd is scheikunde studeren een verworven smaak. Niet iedereen zal deze wetenschappelijke discipline waarderen, waarbij elementen, verbindingen die zijn samengesteld uit atomen, moleculen en ionen, worden onderzocht. Het begrijpen van hun samenstelling, structuur, eigenschappen en gedrag kan voor de een gewoon zijn en de ergste nachtmerrie voor de ander.
Toch heeft het bestuderen van elementaire scheikundeconcepten veel voordelen vanwege het feit dat het bekend staat als centrale wetenschap. De reden daarvoor is dat het wiskunde, natuurkunde, biologie en geneeskunde combineert. Het veld van de natuurkunde is behoorlijk uitgebreid met veel verschillende praktijken die kunnen worden bestudeerd en die veel interessante onderwerpen behandelen die elke wetenschapsliefhebber diep zullen intrigeren. Je kunt hier meer lezen over de belangrijkste scheikunde terminologie.
Zonder verder oponthoud zal Superprof enkele van de basisconcepten van de natuurkunde bespreken, zoals chemische reacties, de elementen, de Lewis-structuur, het periodiek systeem en vloeistoffen en gassen om er maar een paar te noemen.
Het maakt niet uit of je van wetenschap houdt of niet, deze blog zal iedereen instrueren over de grondbeginselen van scheikunde en hen de mogelijkheid bieden om hun mannetje te staan als het onderwerp in een gesprek ter sprake komt!

Chemische Reacties

Even tussendoor - zoek je toevallig naar scheikundelessen bij jou in de buurt? Ga gerust aan de slag met onze ervaren privéleraren op Superprof!
Chemische reacties worden de hele tijd ervaren. Of je nu kookt, vuur maakt of inademt, er wordt een chemische reactie uitgelokt.
In een chemische reactie worden de moleculen of ionen herschikt en gevormd tot een nieuwe structuur. De atoomkern blijft onaangeroerd en alleen de elektronen worden overgedragen om chemische verbindingen te vormen. Het aantal atomen van de elementen verandert niet en blijft van het begin tot het einde van de chemische reactie hetzelfde. Dit was de ontdekking van een zekere Antoine Lavoisier, over wie je meer kunt lezen in ons stuk over de beroemdste scheikundigen ooit.
Het is erg belangrijk op te merken dat chemische reacties verschillen van fysieke veranderingen en het meest opvallende verschil is dat bij een chemische reactie de atomen nieuwe producten, moleculen en verbindingen vormen, terwijl bij een fysieke verandering de atomen dezelfde rangschikking behouden als voorheen.
Het is onmogelijk om de moleculaire verandering van een chemische reactie in het volle zicht op te merken. Toch zijn er tekenen die mensen helpen het verschil op te merken, zoals temperatuurverandering, bubbels of kleurverandering.
De atomen en moleculen die op elkaar reageren, worden de reactanten genoemd en de atomen en moleculen die door de reactie worden geproduceerd, worden producten genoemd. Daarom zou de chemische vergelijking als volgt zijn:
reactant1 + reactant2 + ... ----->
... product1 + product2 + ...
Degenen die scheikunde hebben gestudeerd en een basis hebben van chemische reacties, kunnen de vergelijking in een verkorte versie schrijven:
a A
+ b B + ... -----> c C + d D + ...
Chemische reacties kunnen worden onderverdeeld in vier verschillende typen:
- Synthese of directe combinatie;
- Ontleding;
- Enkele vervanging;
- Metathese of dubbele verplaatsing.
Er zijn zoveel voorbeelden van verschillende chemische reacties die dagelijks of wekelijks kunnen worden waargenomen. Hier zijn enkele van de meest opvallende voorbeelden:
- Een vuur aansteken of een vlam maken;
- Het bakken van cake of gebak;
- Een ei koken, braden of roerei;
- Bananen zien rotten;
- Het grillen van een hamburgerpasteitje.
Wat we nu hebben overwogen, is slechts het topje van de ijsberg. Er is zoveel te leren over chemische reacties. Als dit gedeelte je heeft geïnteresseerd en je wilt meer weten, bezoek dan deze informatieve website.
Je kunt ook alles te weten komen over scheikunde met Superprof!
Elementen en het Periodiek Systeem
Voordat je verder leest, zoek je naar scheikundelessen met een ervaren bijlesdocent? Neem snel eens een kijkje in ons aanbod van docenten op Superprof!
Een scheikundig element is een zuivere stof in zijn eenvoudigste vorm die niet verder kan worden afgebroken.
Wetenschappers hebben tot nu toe 118 chemische elementen ontdekt. Van 94 van deze elementen is bekend dat ze vaak in de natuur voorkomen en de overige 24 zijn synthetisch en door de mens gemaakt.
Het meest voorkomende element in ons universum is waterstof en op aarde is het ijzer. Het menselijk lichaam en het meest voorkomende element op aarde is zuurstof.
Een element heeft een enkel atoom en wordt gekenmerkt door het aantal protonen in de kernen van zijn atomen. Dit staat bekend als het atoomnummer en wordt aangegeven met het nummer Z.
Elementen die niet gemengd zijn en in hun puurste staat zijn, hebben allemaal hetzelfde aantal protonen. Terwijl degenen die als mengsels worden beschouwd, verschillende protonen en atomen hebben.
Er zijn slechts een paar elementen die volledig puur zijn en niet zijn gecombineerd. Deze omvatten koper, zilver, goud en zwavel om er maar een paar te noemen. Terwijl een voorbeeld van een gemengd element atmosferische lucht is, een mengsel van stikstof, zuurstof en argon (kleurloos edelgas).
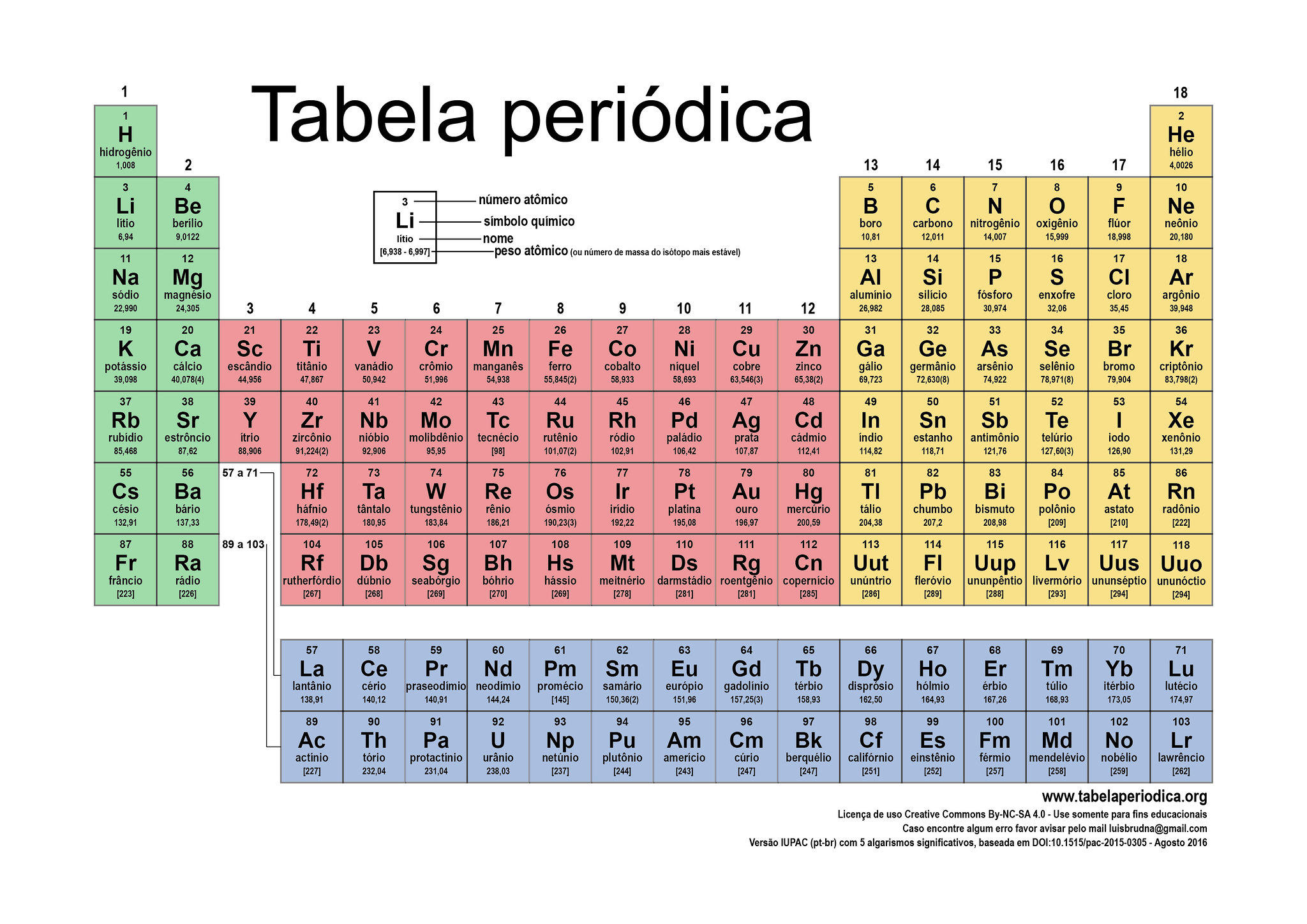
Voorbeelden van verschillende elementen zijn te zien op het periodiek systeem. Het eerste element, met slechts één proton, is waterstof. Het tweede element is helium met twee protonen en het derde is lithium met drie protonen. De elementen en het aantal protonen blijven doorgaan op het periodiek systeem totdat het op 118 komt, het recent ontdekte element van oganesson.
Het periodiek systeem is de meest gebruikte rangschikking van elementen. Elementen zijn georganiseerd en gedeeld door atoomnummer, elektronenconfiguratie en terugkerende chemische eigenschappen. Tabelrijen worden perioden genoemd en kolommen worden groepen genoemd.
Er zijn 18 groepen of kolommen in het periodiek systeem die zijn gemaakt om elementen met vergelijkbaar scheikundig gedrag op dezelfde plaats te plaatsen. Slechts zes van de 18 groepen hebben een naam voor zichzelf geaccepteerd:
- Groep 1: Alkalimetalen;
- Groep 2: Aardalkalimetalen;
- Groep 15: Pnictogen (stikstof familie);
- Groep 16: Chalcogenen (zuurstof familie);
- Groep 17: Halogenen;
- Groep 18: Edelgassen.
De achtergrondkleuren van de elementen identificeren de subcategorie in de metaal-, metalloïde- en niet-metalen trend. Er zijn verschillende periodieke tabellen en kleuren niet gestandaardiseerd. Het hangt meestal af van persoonlijke voorkeur, maar categorieën worden hetzelfde gehouden.
Meer leren over het periodiek systeem kan buitengewoon interessant zijn en mensen helpen het gebruik van verschillende elementen te begrijpen.
Je kunt naar bijles scheikunde gaan om je te helpen de fijne kneepjes van ons periodiek systeem der elementen te begrijpen...
Als je zoekt naar scheikundelessen bij jou in de buurt, neem gerust lessen via Superprof!
Scheikundige Verbinding en de Lewis-Structuur

Chemische verbinding is de aantrekkingskracht tussen atomen, ionen en moleculen die de vorming van scheikundige verbindingen mogelijk maakt. De verbindingen hebben verschillende sterktes vanwege het feit dat sommige sterker zijn, zoals covalente, ionische en metaalverbindingen, en andere zwakker zijn, zoals dipool-dipool-interacties, de Londense dispersiekracht en waterstofverbinding.
De sterkere verbindingen die moleculen bij elkaar houden, worden als permanent beschouwd, terwijl de zwakkere bindingen tijdelijk zijn en na een tijdje uit elkaar vallen. Het maakt niet uit hoe sterk de band is, ze zijn nodig voor de chemie van ons eigen lichaam en het leven zelf.
Wetenschappers hebben ontdekt dat de meest voorkomende reden waarom scheikundige verbindingen worden gevormd, is dat atomen hun meest stabiele energieniveau proberen te bereiken.
In de scheikunde en in het leven trekken tegenpolen elkaar aan. De aantrekkingskracht van de negatief geladen elektronen die rond de kern cirkelen en de positief geladen protonen die zich in de kern bevinden, veroorzaakt een aantrekkingskracht die een scheikundige verbinding creëert.
Er zijn verschillende soorten natuurkundige verbindingen die kunnen worden waargenomen. Daar zijn ze:
- Ionische verbindingen: deze worden gevormd tussen ionen met tegengestelde ladingen. Een voorbeeld hiervan is keukenzout. De positief geladen natriumionen en de negatief geladen ionen worden door elkaar aangetrokken en creëren natriumchloride;
- Covalente verbindingen: atomen worden stabieler door elektronen te delen in plaats van ze te verliezen of te winnen. Covalente bindingen komen veel vaker voor dan ionische bindingen in de moleculen van levende organismen. Hoe meer elektronen er tussen twee atomen worden gedeeld, hoe sterker de covalente binding zal zijn;
- Polaire covalente verbindingen: in dit type binding worden elektronen ongelijk verdeeld door de atomen en brengen ze meer tijd dicht bij elkaar door. Door de ongelijke verdeling van elektronen tussen atomen ontwikkelen de ladingen zich in verschillende delen van het molecuul;
- Niet-polaire covalente verbindingen: deze worden gevormd tussen twee atomen van hetzelfde element of tussen atomen van verschillende elementen die elektronen gelijkelijk delen;
- Waterstofverbindingen: polaire covalente verbindingen met waterstof bevatten een lichte positieve lading omdat de elektronen naar het andere element worden getrokken. Als gevolg van deze aantrekkingskracht zal de waterstof worden aangetrokken door eventuele negatieve ladingen en dit wordt een waterstofbrug genoemd.
Lewis Dot Structuur
De Lewis-puntstructuren tonen de verbinding tussen atomen en moleculen en de eenzame elektronenparen die in het molecuul kunnen voorkomen.
Deze structuur werd in 1916 geïntroduceerd door Gilbert N. Lewis in zijn artikel getiteld The Atom and the Molecule. De Lewis-puntstructuur breidde het concept van het elektronenpuntdiagram uit door enkele lijnen toe te voegen om de gedeelde paren in een chemische verbinding weer te geven.
Het is een snelle en gemakkelijke manier om de valentie-elektronenconfiguratie van afzonderlijke atomen te tonen wanneer er geen eerdere connecties of verbindingen zijn gemaakt.
Zuurgraad en Basiciteit
Stoffen kunnen worden bepaald als een zuur of een base (loog). Een zuur-base-reactie is een veel voorkomende chemische reactie tussen een zuur en een base. Het kan worden gebruikt om de pH van een stof of vloeistof te bepalen.
Veel wetenschappers hebben hun eigen zuur-base-theorieën gemaakt om de pH-waarden te berekenen, de stoffen correct te definiëren en de reacties zorgvuldig te observeren.
Zoek je naar scheikundelessen bij jou in de buurt? Volg je lessen gerust via Superprof. Onze leraren helpen je graag!

Svante Arrhenius Zuren en Basen
Deze theorie van zuren dateert uit 1884 en is een van de meest gebruikte theorieën van vandaag. Arrhenius bracht het grootste deel van zijn tijd door met het observeren van zout en de veranderingen ervan wanneer het in water wordt gedaan. In deze theorie van zuren is water vereist. Alleen protische zuren zijn toegestaan die nodig zijn om waterstofionen te produceren. Alleen hydroxy zuren zijn toegestaan om hydroxide-ionen produceren. Zuren produceren H+-ionen in waterige oplossingen en basen produceren OH-ionen in vloeistoffen.
Gilbert Newton Lewis Zuren en Basen
Dit staat bekend als de minst strikte zuurtheorie vanwege het feit dat alleen elektronenparen worden onderzocht en protonen worden weggelaten. De basisconcepten van deze theorie omvatten het feit dat zuren elektronenpaar acceptoren zijn en dat basen elektronenpaar donoren zijn.
Brønsted-Lowry Theorie van Zuren
Zuur-base reacties worden beschreven als een zuur dat een proton afgeeft en een base die een proton accepteert. Enkele van de kenmerken van deze theorie zijn dat zuren proton donoren zijn, basen proton acceptoren. In zij theorie worden zuren gedefinieerd als stoffen die dissociëren in waterige oplossing om H + (waterstofionen) te geven, terwijl basen worden gedefinieerd als stoffen die dissociëren in waterige oplossing om OH − (hydroxide-ionen) te geven.
Zuren hebben verschillende eigenschappen en kunnen worden onderscheiden door hun zure smaak, corrosief gedrag, wateroplossingen geleiden elektrische stromen en ze reageren met basen om zouten en water te creëren. Dit zijn slechts enkele van de eigenschappen, zuren kunnen ook op andere manieren worden bepaald.
Basen kunnen worden onderscheiden van zuren als de smaak bitter is, glad of zeepachtig aanvoelt en de kleur van lakmoes (een blauwe plantaardige kleurstof) niet verandert.
Verschillende soorten zuur die regelmatig kunnen worden waargenomen zijn:
- Citroenzuur;
- Melkzuur;
- Azijn;
- Koolzuur;
- Absorberend zuur.
Enkele voorbeelden van de meest voorkomende basen zijn:
- Wasmiddelen;
- Zepen;
- Loog;
- Huishoudelijke ammoniak.

Zuren en basen kunnen grondiger worden bestudeerd door aanvullende informatie over de eerdergenoemde theorieën te leren.
Scheikunde kan een zeer divers en intrigerend onderwerp zijn om te begrijpen. Als dit wetenschappelijke onderwerp je interesseert, is het belangrijk op te merken dat de basisconcepten door jezelf kunnen worden geanalyseerd in het comfort van je eigen huis. Als je nadenkt over welke wetenschappelijke discipline je moet onderzoeken, is scheikunde de juiste keuze!
Als je honger hebt naar meer informatie, kun je met Superprof meer te weten komen over belangrijke scheikundige ontdekkingen, verbazingwekkende scheikundefeiten of de belangrijkste scheikundeapparatuur.
Samenvatten met AI